dsRNA-Nachweis
Goldstandard Antikörperklon J2
![]()
Die Bildung von doppelsträngiger (ds)RNA ist ein wesentliches Merkmal einiger viraler Infektionen und spielt auch bei Gen-Silencing eine Rolle. Der Nachweis von RNA über Sonden ist dabei methodisch zeitaufwändig, anspruchsvoll und für viele Fragestellungen nicht die optimale Methode.
Im Jahre 1990 wurden deshalb 3 Antikörper entwickelt, die spezifisch dsRNA erkennen und sich für eine Vielzahl von Fragestellungen eignen. Diese wurden in der Publikation von Schönborn et al. (1991) ausführlich charakterisiert. Der Klon J2 hat sich seitdem mit über 200 Publikationen zum Goldstand entwickelt.
Ursprünglich wurde er für die Untersuchung von Pflanzenviren verwendet, aber seit der grundlegenden Arbeit von Weber et al. im Jahr 2006, in der mit J2 gezeigt wurde, dass alle getesteten Positivstrang-RNA-Viren in infizierten Zellen dsRNA produzieren, wurde dieser Antikörper zur Beantwortung einer Vielzahl von Fragestellungen und für diverse Methoden eingesetzt.
Unter anderem eignet sich der Antikörper zur Charakterisierung & Detektion von Viren mit dsRNA-Genomen oder Intermediaten wie SARS, Hepatitis C oder auch von diversen Flavivieren wie Dengue (DENV)- West-Nil-Virus (WNV) und Zika Virus oder generell als diagnostisches Werkzeug zur Identifizierung von unbekannten Erregern viralen Ursprungs als Differentialdiagnose zu bakteriellen Infektionen (Richardson et al., 2010). Ein weiteres Anwendungsgebiet von anti-ds RNA Antikörpern im Labor ist die Qualitätskontrolle von in vitro mRNA Transkriptionsansätzen.
Der anti-dsRNA Antikörper J2 eignet sich dabei für eine Vielzahl von Methoden wie Elektronenmikroskopie, Immunfluoreszenzmikroskopie, Immunhistochemie Blot basierten Methoden wie Dot-Blot und Western Blot sowie ELISA. Hervorzuheben ist dabei auch die Eigenschaft des Antikörpers in der Immunhistochemie auf Paraffin fixierten Zellen (IHC-P / FFPE) gut zu binden
Die ebenfalls entwickelten Klone K1 und K2 stellen für einige Fragestellungen eine Alternative dar oder eignen sich für Methoden, in den 2 Antikörper gegen dsRNA benötigt werden:
| anti-dsRNA (Klon J2) |
anti-dsRNA (Klon K1) |
anti-dsRNA (Klon K2) |
|
|---|---|---|---|
| Spezifität | dsRNA (40+ bp) |
dsRNA (40+ bp) |
dsRNA (40+ bp) |
| Methoden | IHC-P, ELISA, IF, IP, EM, Affinity Purification | IHC-P, ELISA, IF, IP, EM, Affinity Purification | ELISA, IHC, Dot Blot |
| Isotyp | Maus IgG2A / kappa | Maus IgG2A / kappa | Maus IgM / kappa |
| Format | gereinigt Lyophilisiert 500µg (1mg/ml) |
gereinigt Lyophilisiert 500µg (1mg/ml) |
Zellkulturüberstand (10 ml) |
| Empfehlung zur Anwendung | Empfehlung für die meisten Andwendungen (Goldstandard) |
Poly I:C Detektion , Alternative zu J2 im Falle von Kreuzreaktivitäten | 2. Antikörper Sandwich ELISA Alternative AK-Klasse /Subtyp |
| Bestellen | NMB-10010500 | NMB-10020500 | NMB-10030010 |
Mit der Übernahme von SCICONS durch Nordic-MUbio sind die oben genannten Antikörper bei BIOZOL nun erstmals vom Originalhersteller verfügbar.
Referenzen:
- Schönborn, J., Oberstrass, J., Breyel, E., Tittgen, J., Schumacher, J. and Lukacs, N. (1991) Monoclonal antibodies to double-stranded RNA as probes of RNA structure in crude nucleic acid extracts. Nucleic Acids Res.19, 2993-3000.
- Lukacs, N. (1994) Detection of virus infection in plants and differentiation between coexisting viruses by monoclonal antibodies to double-stranded RNA. J. Virol. Methods 47, 255-272.
- Lukacs, N. (1997) Detection of sense:antisense duplexes by structurespecific anti-RNA antibodies. In: Antisense Technology. A Practical Approach, C. Lichtenstein and W. Nellen (eds), pp. 281-295. IRL Press, Oxford.
- F. Weber, V. Wagner, S. B. Rasmussen, R. Hartmann, S. R. Paludan. Double-stranded RNA is produced by positive-strand RNA viruses and DNA viruses but not in detectable amounts by negative-strand RNA viruses. J Virol (2006), 80(10):5059-64. doi: 10.1128/JVI.80.10.5059-5064.2006.
- S. Welsch, S. Miller, I. Romero-Brey, A. Merz, C. K. E. Bleck, P. Walther, S. D. Fuller, C. Antony, J. Krijnse-Locker, R. Bartenschlager. Composition and Three-Dimensional Architecture of the Dengue Virus Replication and Assembly Sites. Cell Host & Microbe (2009) 5(4); 365-375. doi.org/10.1016/j.chom.2009.03.007.
- K. Knoops , M. Bárcena, R. W. Limpens, A. J. Koster, A. M. Mommaas, E. J. Snijder. Ultrastructural characterization of arterivirus replication structures: reshaping the endoplasmic reticulum to accommodate viral RNA synthesis. J Virol. (2012) 86(5); 2474-2487. doi:10.1128/JVI.06677-11.
- S. J. Richardson, A. Willcox, D. A. Hilton, S. Tauriainen, H. Hyoty, A. J. Bone, A. K. Foulis, N. G. Morgan. Use of antisera directed against dsRNA to detect viral infections in formalin-fixed paraffin-embedded tissue. J Clin Virol. (2010) 49(3); 180-5. doi: 10.1016/j.jcv.2010.07.015.
- K. Karikó, H. Muramatsu, J. Ludwig, D. Weissman, Generating the optimal mRNA for therapy: HPLC purification eliminates immune activation and improves translation of nucleoside-modified, protein-encoding mRNA, Nucleic Acids Research (2011) 39(21); e142, https://doi.org/10.1093/nar/gkr695.
25.05.2021
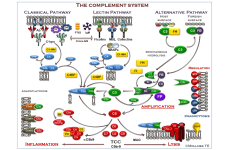
Komplementsystem
Wieslab® Funktionale Assays von Svar
Langzeit-Organoid-Ku...
Afamin/Wnt3a-Komplex - jetzt mit 10 % Rabatt

Unbeschichtete ELISA...
Die kostengünstige Wahl – jetzt mit 30 % Rabatt

Mikroplastik
Referenzmaterialien von LGC Standards - mit 20 % Rabatt!
CUT&Tag-IT
Genomweite Analyse von Histonmarkierungen

