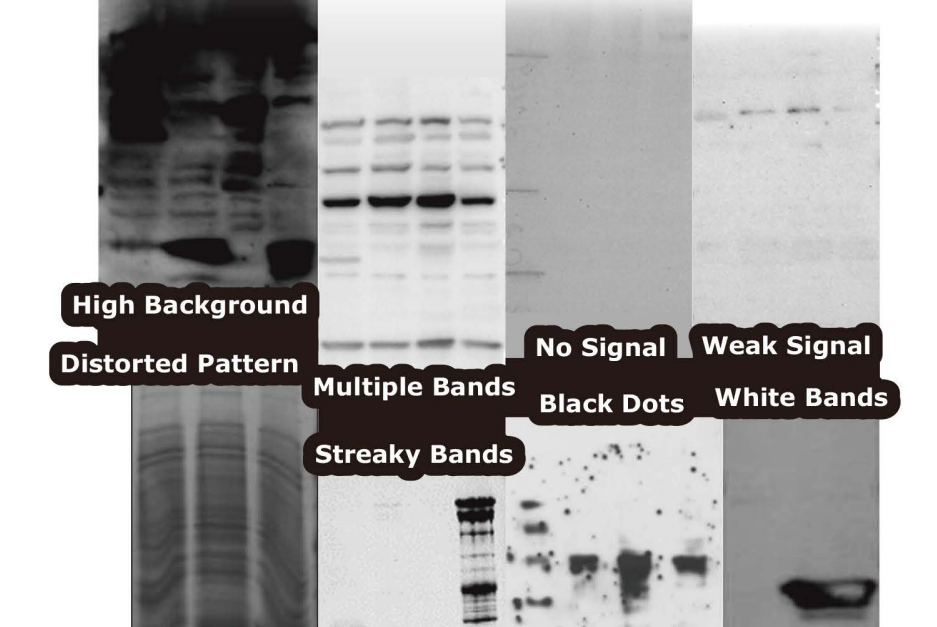
Western Blot
Tipps zur Fehlerbehebung im Western Blot

Unsere Partnerfirma GeneTex unterstützt Forscher mit einer umfassenden Auswahl an Tipps zur Fehlerbehebung für viele Probleme, die bei einem Western Blot (WB) Experiment auftreten können
Laden Sie auch den Western Blot Troubleshhoting Guide von GeneTex als pdf herunter.
Achten Sie darauf, die richtigen Positiv- und Negativkontrollen zu laden, um sicherzustellen, dass das WB-Verfahren korrekt durchgeführt wird.
Q2: Multiple oder extra Banden
Q5: Weiße Banden auf schwarzen Blots
Q8: Irreguläre weiße Verfärbungen auf dem Blot
Q1: Kein Signal
Mögliche Gründe:
1) Unzureichende Proteinmenge
a. Unzureichende Zelllyse Stellen Sie sicher, dass die Zelllyse und die Proteinextraktion ordnungsgemäß erfolgen.
b. Proteinabbau Geben Sie dem Lysepuffer vor der Zelllyse immer Proteaseinhibitoren zu und führen Sie die Proteinextraktion auf Eis durch, um Proteinabbau zu vermeiden.
c. Geringe Expression des interessierenden Proteins Erhöhen Sie die Menge des auf das Gel geladenen Proteinextrakts, um dieses Problem zu lösen. Wenn das interessierende Protein gewebe- oder zelltypspezifisch exprimiert wird, stellen Sie sicher, dass Sie diesen spezifischen Gewebe- oder Zelltyp für Ihre Experimente auswählen.
d. Das Protein von Interesse ist in einer bestimmten Organelle angereichert. Eine biochemische Fraktionierung subzellulärer Kompartimente kann notwendig sein, um diese Art von Protein nachzuweisen.
e. Die Expression des interessierenden Proteins wird nur unter bestimmten Bedingungen induziert. Überprüfen Sie die einschlägige Literatur, um festzustellen, ob eine Behandlung (z. B. Hungern oder chemische Mittel) erforderlich ist, um eine angemessene Proteinexpression zu induzieren.
2) Unzureichender Transfer des Proteins vom Gel zur Membran
a. Unvollständiger Transfer Stellen Sie sicher, dass die PVDF-Membran während des Transfers nass bleibt. PVDF-Membranen müssen vor dem Transfer durch Einwirkung von Methanol "aktiviert" werden. Ziehen Sie vor dem Experiment die Gebrauchsanweisung für die PVDF-Membran zu Rate. Die reversible Ponceau S-Membranfärbung ist ein einfacher Schritt zur Bestätigung des Proteintransfers.
b. Über-Transfer Bitte passen Sie die elektrische Spannung und den Zeitrahmen für den Transfer an. Die Bedingungen sollten in Abhängigkeit vom Molekulargewicht des Zielproteins optimiert werden. Beachten Sie, dass Proteine mit hohem Molekulargewicht eine längere Zeit für den Transfer benötigen können.
3) Antikörper-Hybridisierung und Waschvorgang
a. Unzureichender primärer oder sekundärer Antikörper Verwenden Sie die empfohlenen Antikörperverdünnungen, die auf dem Produktdatenblatt beschrieben sind, als Ausgangspunkt für Ihr Experiment. Bei schwach exprimierten Proteinen kann es notwendig sein, die Konzentration des Antikörpers zu erhöhen. Vermeiden Sie die Wiederverwendung von primären Antikörpern, wann immer dies möglich ist.
b. Unzureichende Inkubationszeit mit dem primären Antikörper Eine einstündige Inkubation bei Raumtemperatur ist normalerweise für den Nachweis der meisten Proteine ausreichend. In einigen Fällen kann es erforderlich sein, die Inkubationszeit zu verlängern (z. B. Inkubation über Nacht bei 4 °C).
c. Falscher Sekundärantikörper Vergewissern Sie sich, dass der richtige Sekundärantikörper verwendet wird. Wählen Sie einen sekundären Antikörper, der gegen die spezifische Wirtsspezies und den Immunglobulintyp des primären Antikörpers gerichtet ist (d. h. ein primärer Antikörper, der in Kaninchen mit Isotyp IgG gezüchtet wurde, erfordert einen sekundären Antikörper gegen Kaninchen IgG). Alle Informationen zu Wirtsspezies und Isotyp finden Sie auf dem Datenblatt des primären Antikörpers.
d. Übermäßiges Waschen der Membran Drei Waschvorgänge von jeweils 5~10 Minuten sind in den meisten Fällen ausreichend, um die unspezifische Bindung auszuwaschen. Vermeiden Sie übermäßiges Waschen der Membran, da dies die Menge des an das Zielantigen gebundenen primären Antikörpers verringern kann.
4) Schlechte Aktivität der ECL-Detektionsreagenzien.
Stellen Sie sicher, dass die ECL-Reagenzien nicht abgelaufen sind. ECL-Reagenz verliert mit der Zeit an Aktivität, daher bereiten Sie das Reagenz immer unmittelbar vor der Detektionsreaktion vor.
5) Natriumazid-Interferenz.
Natriumazid (NaN3) ist ein Inhibitor von HRP und kann die HRP-Aktivität unterdrücken. Stellen Sie sicher, dass sich kein Natriumazid im Antikörper-Verdünnungspuffer befindet und waschen Sie die Membran vor der Nachweisreaktion gründlich.
Q2: Multiple oder extra Banden
Mögliche Gründe:
1) Posttranslationale Modifikationen am Protein von Interesse
Die posttranslationale(n) Modifikation(en) können zu mehreren Banden führen. Das modifizierte Protein erscheint normalerweise als Bande(n) oberhalb des vorhergesagten Molekulargewichts. Schauen Sie in der Literatur nach, ob es bekannte Modifikationen des Zielproteins gibt.
2) Proteinabbau
Der Proteinabbau führt ebenfalls zu Mehrfachbanden. Das degradierte Protein wird in der Regel als mehrere Banden unterhalb des vorhergesagten Molekulargewichts gesehen. Stellen Sie sicher, dass dem Proteinextraktionspuffer Proteaseinhibitoren zugesetzt wurden. Vermeiden Sie wiederholte Gefrier-/Auftauzyklen des Zelllysats.
3) Protein-Multimerisierung
Kochen Sie die Proben ordnungsgemäß aus, um eine angemessene Denaturierung der Proteine zu gewährleisten. Denken Sie daran, dass frisch zugegebenes Dithiothreitol (DTT) oder 2-Mercaptoethanol (2-ME) im Probenpuffer für die Reduktion von Disulfidbindungen erforderlich ist.
4) Alternative Spleißformen oder neuartige Proteine, die ähnliche Epitope aufweisen.
Schlagen Sie in der Literatur nach und suchen Sie mit BLAST nach dem gewünschten Protein. Laden Sie eine empfohlene Positivkontrolle.
5) Die Konzentration des primären Antikörpers ist zu hoch
Verringern Sie die Konzentration des primären Antikörpers oder reduzieren Sie die Inkubationszeit.
6) Die Konzentration des sekundären Antikörpers ist zu hoch
Verringern Sie die Konzentration des sekundären Antikörpers. Inkubieren Sie nur mit einem sekundären Antikörper (ohne primären Antikörper) als Kontrolle.
7) Unspezifische Bindung
Erhöhen Sie die Dauer des Waschens oder erhöhen Sie die Konzentration der Detergenzien im Waschpuffer.
Q3: Hoher Hintergrund
Mögliche Gründe:
1) Die Konzentration des primären oder sekundären Antikörpers ist zu hoch.
Passen Sie die Konzentration des primären oder sekundären Antikörpers an.
2) Überbelichtung
Verringern Sie die Belichtungszeit der Membran.
3) Unzureichende Blockierung
Erhöhen Sie die Inkubationszeit mit Blocking-Puffer und stellen Sie sicher, dass ein geeigneter Blocking-Puffer verwendet wird.
4) Unzureichendes Waschen
Erhöhen Sie die Dauer des Waschens oder erhöhen Sie die Konzentration der Detergenzien im Waschpuffer.
5) Im Blockierungspuffer vorhandene Antigene können mit primären oder sekundären Antikörpern kreuzreagieren
Ändern Sie den Blockierungspuffer (z. B. von fettfreier Milch zu 3%~5% BSA oder verwenden Sie einen proteinfreien Blockierungspuffer)
6) Die Membran ist während der Inkubation ausgetrocknet
Halten Sie die PVDF-Membran während der Inkubation feucht.
7) Ungeeignete Membran verwendet
Wählen Sie den geeigneten Membrantyp für Ihr Experiment (z. B. ist die PVDF-Membran empfindlicher als die Nitrocellulose-Membran).
Q4: Schmiermuster
Mögliche Gründe:
1) Überladung der Proteinprobe
Verringern Sie die Menge des auf das Gel geladenen Proteins.
2) Schlechte Gelvorbereitung
Vergewissern Sie sich, dass die SDS-PAGE-Gelmischung richtig vorbereitet ist und dass das gegossene Gel vollständig polymerisiert. Überprüfen Sie bei Gelen, die bei 4°C gelagert wurden, dass sie nicht ausgetrocknet sind.
Q5: Weiße Banden auf schwarzen Blots
Mögliche Gründe:
1) Die Konzentration des primären oder sekundären Antikörpers ist zu hoch.
Reduzieren Sie die Konzentration des primären und/oder sekundären Antikörpers.
2) Die Konzentration des Zielproteins ist zu hoch
Verringern Sie die Menge des gereinigten Proteins oder des Zelllysats, das auf das Gel geladen wird.
Q6: Schwarze Punkte
Mögliche Gründe:
1) Reagenzien sind verunreinigt
Stellen Sie sicher, dass die Reagenzien ordnungsgemäß gelagert werden. Wenn möglich, bereiten Sie vor jedem Experiment frische Reagenzien vor.
2) Die Antikörper binden an ungelöstes Blocking-Reagenz
Vergewissern Sie sich, dass das Blocking-Reagenz (z. B. fettfreies Milchpulver) vollständig aufgelöst ist. Filtern Sie ggf. das Blocking-Reagenz.
Q7: Verzogene Banden
Mögliche Gründe:
1) Schlechte Gelvorbereitung
Vergewissern Sie sich, dass die SDS-PAGE-Gelmischung richtig vorbereitet ist und dass das gegossene Gel vollständig polymerisiert. Prüfen Sie bei Gelen, die bei 4 °C gelagert wurden, dass sie nicht ausgetrocknet sind.
2) Die Gel-Laufgeschwindigkeit ist zu schnell
Verlangsamen Sie die SDS-PAGE-Gel-Laufgeschwindigkeit, indem Sie die Spannung reduzieren.
3) Die Gel-Lauftemperatur ist zu hoch
Das "Lächeln" der migrierenden Proteine kann durch zu hohe Lauftemperaturen verursacht werden. Um dies zu verhindern, lassen Sie das Gel mit einer niedrigeren Spannung laufen oder kühlen Sie das Gel, indem Sie es in einem kalten Raum oder auf Eis laufen lassen.
4) Luftblasen, die während des Transfers im Spalt zwischen Membran und Gel eingeschlossen sind.
Stellen Sie sicher, dass alle Luftblasen vor dem Transfer entfernt werden.
5) Die Membran wurde nicht vollständig vom Antikörper bedeckt.
Vergewissern Sie sich, dass die Membran während der Inkubation mit einem ausreichenden Volumen an Reagenzien bedeckt ist.
Q8: Irreguläre weiße Verfärbungen auf dem Blot
Mögliche Gründe:
1) Luftblasen, die während des Transfers im Spalt zwischen Membran und Gel eingeschlossen sind.
Stellen Sie sicher, dass alle Luftblasen vor dem Transfer entfernt werden.
2) Die Membran wurde nicht vollständig vom Antikörper bedeckt.
Vergewissern Sie sich, dass die Membran während der Inkubation mit einem ausreichenden Volumen an Reagenzien bedeckt ist.